事项编码
- A-00501-140623
- 事项名称
第三类医疗器械经营许可
基本编码
000172028000
实施编码
1114060073403594XW3000172028000
受理条件
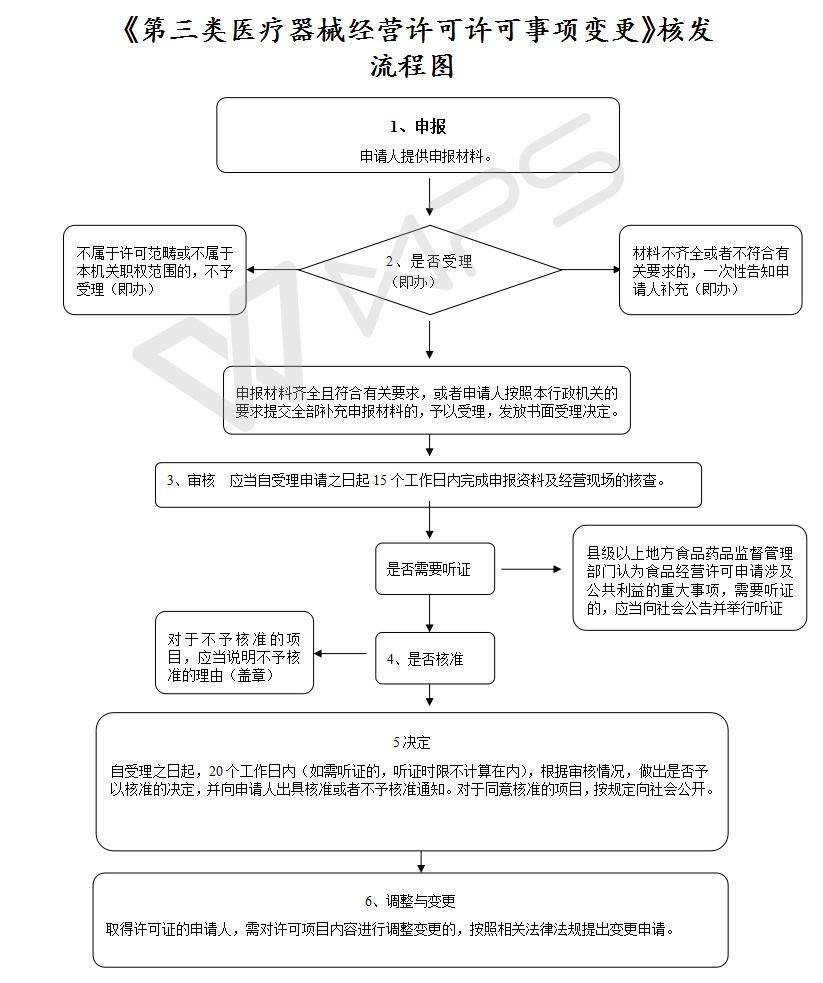
1、《医疗器械监督管理条例》第三十一条 从事第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府食品药品监督管理部门申请经营许可并提交其符合本条例第二十九条规定条件的证明资料。《医疗器械经营监督管理办法》第八条 从事第三类医疗器械经营的,经营企业应当向所在地设区的市级食品药品监督管理部门提出申请
服务对象
法人
服务主题
准营准办
许可事项属性
无属性
网办深度
二级:该事项已经实现申请材料在线预审。申请人可以通过网络提交和补正相关申请信息和材料,审核机构在平台对提交材料进行预审,预审通过后申请人仍需携带材料原件到现场提交办理,作出审批决定后,申请人可来现场领取结果,也可选择物流递送形式递送审批结果。整个办理过程赢到现场不超过两次。
是否一次办
否
是否就近办
否
办理期限
法定期限: 30 个工作日
承诺期限: 20个工作日
办件类型
承诺件
是否收费
否
特别程序
现场勘查
特别程序期限
15个工作日
前置事项
无
是否进驻大厅
是
是否可网上办理
是 是否开通网上预约:否
是否需要中介服务
否
到窗口办理次数
1次
是否设置审批情形
否
是否投资审批项目:
否
事项风险等级设置
A
通办范围
数量限制
无限制
是否一窗办理
否
办事地址
朔州市政务服务中心一楼西市场监管窗口 市场监管局窗口
咨询电话:15703496689
办公时间:周一至周五:9:00-17:00;法定节假日不对外办理业务
电子邮箱: 网址:
1、办事窗口:市场监管局窗口 办事地址:朔州市政务服务中心一楼西市场监管窗口 咨询电话:15703496689
|
法律依据列表: |
| |||||||||||||||||||||||||||
|
序号 |
法律法规位阶 |
法律法规名称 |
条款名称 |
条款内容 |
| |||||||||||||||||||||||
|
1、 |
|
医疗器械经营监督管理办法 |
第十六条、第十七条 |
第十六条《医疗器械经营许可证》事项的变更分为许可事项变更和登记事项变更。许可事项变更包括经营场所、经营方式、经营范围、库房地址的变更。登记事项变更是指上述事项以外其他事项的变更。第十七条许可事项变更的,应当向原发证部门提出《医疗器械经营许可证》变更申请,并提交本办法第八条规定中涉及变更内容的有关资料。 |
| |||||||||||||||||||||||
|
2、 |
|
《医疗器械监督管理条例》 |
第三十一条 |
《医疗器械监督管理条例》第三十一条 从事第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府食品药品监督管理部门申请经营许可并提交其符合本条例第二十九条规定条件的证明资料。《医疗器械经营监督管理办法》第八条 从事第三类医疗器械经营的,经营企业应当向所在地设区的市级食品药品监督管理部门提出申请 |
| |||||||||||||||||||||||
|
|
1 |
组织机构与部门设置说明 |
其他 |
1 |
0 |
是 |
申报提交材料 |
企业 |
如变更项目涉及则提供 |
|
||||||||||||||||||
|
2 |
经营范围、经营方式说明 |
其他 |
1 |
0 |
是 |
申报提交材料 |
企业 |
如变更项目涉及则提供 |
|
|||||||||||||||||||
|
3 |
经营场所、库房地址的地理位置图、平面图、房屋产权或者租赁协议(附房屋产权)复印件 |
其他 |
1 |
1 |
是 |
申报提交材料 |
企业 |
如变更项目涉及则提供 |
|
|||||||||||||||||||
|
4 |
经营设施、设备目录 |
其他 |
1 |
0 |
是 |
申报提交材料 |
企业提供 |
如变更项目涉及则提供 |
|
|||||||||||||||||||
|
5 |
经营质量管理制度、工作程序等文件目录 |
其他 |
1 |
0 |
是 |
申报提交材料 |
企业 |
如变更项目涉及则提供 |
|
|||||||||||||||||||
|
6 |
委托书 |
其他 |
1 |
0 |
是 |
申报提交材料 |
企业 |
|
|
|||||||||||||||||||
|
7 |
签字并加盖公章的申请表 |
在线表单 |
1 |
0 |
是 |
申报提交材料 |
企业 |
|
|
|
|
|
|
|
|
| ||||||||||||
- 受理阶段责任:公示依法应当提交的材料;一次性告知需要补正的申请材料全部内容。2.审核阶段责任:审核资料完整性、真实性,提出审查意见;组织人员现场勘验,审查是否符合许可条件,提出审查意见。3.决定阶段责任:做出准予或不予许可的决定(依据法定方式进行,不予许可的书面说明理由)。4.送达阶段责任:制作证书,送达并公开信息。5.事后监督责任:开展后续监督管理。6.其他:法律法规政策规定应履行的责任。





 晋公网安备14062302000009号
晋公网安备14062302000009号